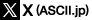【JSTnews2月号掲載】特集1
「見つける・調べる・操る」をキーワードにRNAの化学修飾を探求
2026年02月09日 12時00分更新
RNAは、一般にはDNAの遺伝情報からたんぱく質を合成する過程を仲介する分子として知られている。だが、近年の研究で、生命機能の維持や病気などさまざまな生命現象に直接関わっていることが明らかになりつつある。東京大学大学院工学系研究科の鈴木勉教授は、RNAに他の分子が付加される「RNA修飾」を探求。RNA修飾がつかさどる生命機能の機構を解明し、RNA修飾を操作することで、創薬や病気の治療に貢献する技術基盤の確立を目指している。
クローバーの葉のような構造
1カ所のメチル化で性質が激変
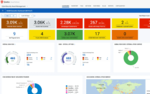
生物の遺伝情報は細胞核内のデオキシリボ核酸(DNA)に書き込まれている。DNAの情報はメッセンジャーRNA(mRNA)に転写されて細胞核の外部に運び出された後、リボソーム上でmRNAの塩基配列に応じてアミノ酸が連結し、生物の体を構成するたんぱく質が作られる。この過程で、遺伝情報の通りにアミノ酸をつなげる役割を果たすのが転移RNA(tRNA)だ(図1-左)。tRNAはクローバーの葉のような構造をしており、mRNAの3つの塩基の並びに対応するアミノ酸が結合している。
ある分子に糖やメチル基などが結合することを「修飾」といい、化学の分野では狙った性質を持つ分子を作るための方法としてよく使われている。実はこれと同じことが細胞内において、転写後のRNAでも起こっており、20世紀後半になると、tRNAはメチル基が結合するメチル化やアセチル基が結合するアセチル化などさまざまな修飾を受けていることがわかってきた(図1-右)。これを「RNA修飾」と呼ぶ。
RNA修飾に魅了された一人が、東京大学の鈴木勉教授だ。約30年前、東京工業大学(現・東京科学大学)の学生としてtRNAの研究をしていた時、tRNAが多くの修飾を受けていることに感銘を受け、以来RNA修飾の研究を続けている。「1カ所がメチル化するだけで性質が劇的に変化することに驚きました」と当時を振り返る。
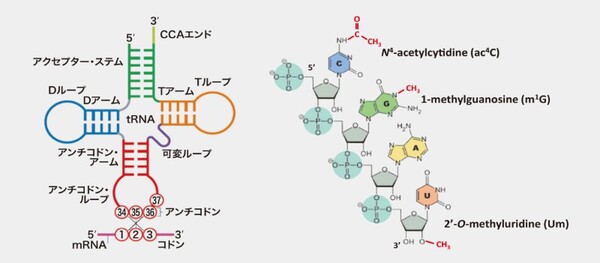
図1 tRNAの構造(左)。折りたたまれてL字型の立体構造をとり、3'末端にアミノ酸が結合し、34、35、36番目の位置にあるアンチコドンが、コドンと呼ばれるmRNA上の3つの塩基の並びと相補的に結合する。右図の赤字部分はRNA修飾の例。上の2つは塩基で修飾が起こり、下の1つはリボースという糖で修飾が起こっている。
150種類以上、新顔が次々登場
2020年にERATOで研究始動
RNAと同じ核酸分子であるDNAも修飾を受けるが、ヒトではシトシンという塩基におけるメチル化がほとんどで、他には数種類しか見つかっていない。それに対してRNA修飾はすでに150種類以上も発見されており、今も次々と新しいRNA修飾が登場している。鈴木さんの研究チームは、21世紀に入って発見された23種類のRNA修飾のうち13種類を見つけており、未発表のものもまだ20種類ほどあるという。
鈴木さんは、2020年に始まったJSTのERATO「鈴木RNA修飾生命機能プロジェクト」の研究総括として、DNAの遺伝情報転写後の段階における遺伝子の発現制御機構を解明するプロジェクトを牽引(けんいん)。RNA修飾が担う機能と普遍的な生命現象との関連性を解明するため、RNA修飾を「見つける」「調べる」「操る」という3本柱を掲げて研究を推進している(図2)。プロジェクトは4つの研究グループで構成され、新規のRNA修飾を探索して機能を解明するだけでなく、革新的なRNA修飾の解析技術や機能制御技術も開発し、疾患の原因解明や創薬・治療につながる技術の基盤構築に貢献したい考えだ。
生物の耐熱性を支える「錠前」
可逆的リン酸化修飾を明らかに
プロジェクトではすでに80本を超える論文を発表している。「見つける」に関するトピックスの1つとして、2022年にNature誌で発表した「生物の耐熱性を支える『錠前』の発見」がある。この研究では、tRNAで可逆的なリン酸化修飾を発見し、この修飾がtRNAに耐熱性やRNA分解酵素に対する耐性を与えることで、生物の耐熱性に寄与することを明らかにした。
リン酸基が結合するリン酸化修飾はたんぱく質ではよく起こっているが、RNAで見つけたのは鈴木さんらが初めてだ。鈴木さんの研究室に所属する大平高之助教が、高熱環境で生きるアーキアのtRNAを調べていた時、47番目の塩基であるウリジンでリン酸化修飾が起こっていることを発見(図3-左)。さらに、その修飾を起こす酵素を作ることができない変異株は、高温での生存率が低下することがわかった(図3-右)。
鈴木さんらは、この修飾がなぜ耐熱性に関わるのかを解明するため、東京大学大学院新領域創成科学研究科の富田耕造教授らと共同でX線結晶構造解析を実施した。tRNAは、折りたたまれてL字型の立体構造をとる際に、疎水性の塩基が内側に集まることで立体構造が安定化するが、高温になると立体構造が崩れてしまい、熱変性で機能が失われてしまう。しかし、リン酸基は親水性のため、立体構造の中で溶媒側、つまり外側を向くことで、高温下で構造が崩壊しかけても歯止めをかけていることがわかった。
鈴木さんは「このリン酸化修飾は立体構造を完全に固定化するものではなく、立体構造にある程度の柔軟性を持たせながらも熱変性を防いでいます。南京錠のように多少の遊びを持たせつつ立体構造をつなぎ止めるようなものです」と例える。
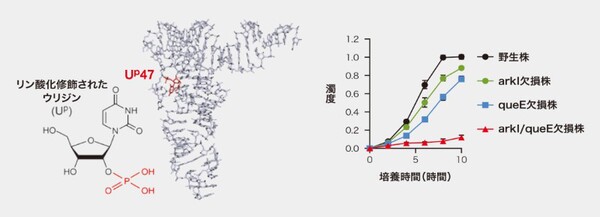
図3 左はリン酸化修飾されたウリジン(Up)の構造と、tRNAにおける位置(Up47)。右のグラフは、87度におけるアーキアの耐熱性を調べた実験結果。縦軸の単位は、波長660ナノ(ナノは10億分の1)メートルの光で測定した濁度。Upを作り出す修飾酵素の遺伝子(arkI)と、tRNAの構造に剛直性を与える遺伝子(queE)の両方が欠損した株では高温での生存率が著しく低下した。
ホウレンソウから貴重な成果
「環境応答型スイッチ」も発見
2025年には、植物の葉緑体やミトコンドリアと、コレラ菌や緑膿(りょくのう)菌を含む一部の病原性細菌に共通して存在する新たなtRNA修飾を発見。鈴木さんらはこの研究のために、大学近くのスーパーでホウレンソウを40キログラム購入し、微量なtRNAを精製するために独自に開発した「全自動往復循環クロマトグラフィー」(図4)を用いて3.3ミリグラムのtRNAを精製したそうだ。
さらに、この時に見つけた修飾がたんぱく質合成に欠かせない働きをしていることも突き止めた。「40キログラムの材料からたったの3.3ミリグラムしか集まらないのかと思うかもしれませんが、これでも材料としては少ない方です」と鈴木さんは笑う。tRNAの機能を調節することで、植物の育成や病原菌による感染症の治療に活用できる可能性のある貴重な研究成果といえる。
また、同年12月には、低酸素環境で大腸菌のリボソームRNA(rRNA)において「RNA骨格」がメチル化修飾されることを世界で初めて発見。この新しい骨格メチル化が、リボソームの構造と活性を微調整し、低酸素下における翻訳効率を高め、生育を促進する「環境応答型スイッチ」として働くことを見いだした。この成果は、RNA修飾が生育環境を感知して、たんぱく質合成を調節するというこれまでに知られていなかった仕組みを明らかにするとともに、無細胞たんぱく質合成や合成生物学において有用な技術基盤となる可能性がある。
糖を付加する2つの酵素同定
生物の健全な生育に不可欠
2つ目の柱である「調べる」に関する成果の1つとして、鈴木さんらは2023年に「tRNAの糖修飾がたんぱく質合成速度を調節する」ことをCell誌に発表した。この研究では、tRNAに、ガラクトースおよびマンノースと呼ばれる糖をそれぞれ付加する酵素2種類を同定し、その分子基盤を明らかにした。さらに、これらの修飾がたんぱく質合成速度を調節しており、小型熱帯魚の一種であるゼブラフィッシュによる実験で生物の健全な生育に不可欠であることも示した。
一部のtRNAでは34番目の塩基で特別な修飾が起こり、この修飾が起こった塩基に、さらにガラクトースまたはマンノースが付加する。この現象は1976年に発見されていたが、詳しい仕組みや機能はわかっていなかった。鈴木さんの研究室で当時大学院生だった2人が、この修飾が起こった塩基にガラクトースを付加する酵素「QTGAL」と、マンノースを付加する酵素「QTMAN」をそれぞれ発見し、これらの酵素がないとmRNAからたんぱく質を合成する翻訳速度が速くなること、加えて新生たんぱく質がうまく折りたたまれないことを、細胞実験で確認した。つまり、tRNAの糖付加修飾はたんぱく合成の速度を調節することで、適切な翻訳速度を維持し、たんぱく質の品質や機能を維持するための機構の維持に貢献することを示したのだ。
さらに、ゼブラフィッシュを用いた実験で、遺伝的にこれらの酵素を作ることができない個体は生後の成長速度が遅くなり、体長が短くなることもわかった。翻訳速度は速ければ良いわけではなく、糖を付加することによる翻訳速度の適切な調節が、生物の健全な成長には必要であるということだ。
現在は、該当する修飾を引き起こす遺伝子を欠損させたマウスを作り、それらの酵素の働きを調べている。これまでに、QTGALを持たないマウスは明るい部屋にいる時間が減少する不安傾向を示し、QTMANを持たないメスのマウスは活動量が増加するという結果が得られている。さらに、QTMANを持たないマウスは肥満体型になることもわかっており、鈴木さんは、これらの表現型がtRNA修飾の欠損によってなぜ生じるのかを詳しく調べている最中だという。「これらの酵素がヒトの病気、例えば、精神疾患やがんと関わっているかもしれません。そうした可能性も明らかにしたいと考えています」。
ミトコンドリア病の治療に有望
ナノポア通じた網羅的検出も
3つ目の柱である「操る」に関する研究でも成果が出始めている。鈴木さんらは、ミトコンドリアDNAに変異を持つことで発症するとされる「ミトコンドリア脳筋症(MELAS病)」の患者ではtRNAにタウリン修飾が起こっていないことを発見し、さらに、MELAS病患者の細胞を使った実験でtRNAの機能回復に成功した。
健常者ではMTO1と呼ばれる酵素によってtRNAのウリジンにタウリン修飾が起こる。しかしMELAS病患者では、tRNAのアデニンであるべき塩基がグアニンに変化しているため、MTO1がtRNAを認識できず、ウリジンにタウリン修飾が起こらない。鈴木さんらはMTO1を過剰に発現させて細胞内で大量に作らせることで、tRNAのタウリン修飾を回復し、細胞のたんぱく質合成および呼吸活性が向上することを示した(図5)。
MELAS病は脳卒中に似た発作が起こる難病で、これまで有効な治療が存在せず、予後も悪いとされている。鈴木さんらは現在、東京大学医科学研究所の岡田尚巳教授と共同で、アデノ随伴ウイルスを用いたMELAS病の遺伝子治療の研究をしており、ゲノム編集による治療が難しいミトコンドリア病の治療に有望視されている。
こうした研究の一方で、鈴木さんらのプロジェクトではRNA修飾を網羅的に検出する技術の開発も進めてきた。その1つが「ナノポアシーケンサー」という装置を使ったtRNA修飾の1分子解析だ。ナノポアシーケンサーを使った解析では、RNAを1本のひもの状態にして、膜たんぱく質で構成されたナノポアと呼ばれる小さな穴に通し、その際の電流の変化で塩基配列を調べる。
鈴木さんらは、RNA修飾はナノポアを通過する際に特徴的な電流値を示すことに着目。個々のtRNAが通過した際に生じる特徴的な電流波形のパターンを機械学習することで、塩基配列だけでなく、1分子ごとにtRNA修飾の有無や修飾率まで検出できるようにした。tRNA修飾を網羅的に調べることは、病気の原因解明や診断に有用だ。
セントラルドグマにおけるRNAの役割は、高校の教科書にも書かれているほど自明のこととなっている。だが、そこではRNA修飾という柔軟性のある制御があることや、RNA修飾の欠損が病気に関わることはほとんど触れられておらず、研究分野として非常に新しいといえる。プロジェクト終了後もさらなるRNA修飾の研究を進めることで、生命現象の理解や医療への応用につながっていくだろう。

この連載の記事
-
第66回
TECH
あらゆる元素を扱う無機合成化学で新材料を創出し、社会問題の解決へ -
第65回
TECH
手術後の胆汁の漏れを防ぐ新たなハイドロゲルを開発 -
第64回
TECH
脳内の隙間細胞による、記憶を選んで残すメカニズム解明へ -
第63回
TECH
地磁気の約200万倍・110テスラの磁場を発生する、移動可能な小型磁場発生装置を開発 -
第62回
TECH
女王を中心とした分業制社会をつくるハダカデバネズミの行動を解明 -
第61回
TECH
量子ビームが生み出す新しい細胞培養用ゲル材料 -
第60回
TECH
海水の温度差を利用し発電する、持続可能な再生可能エネルギー -
第59回
TECH
脱炭素への道筋を論理的・定量的に提示する「社会シナリオ」とは? -
第58回
TECH
アンデス・アマゾン考古学で探る人と自然の共生システム -
第57回
TECH
「誰」を優先対象とすべきか、ポストコロナ時代の新型コロナワクチン接種 - この連載の一覧へ