【JSTnews11月号掲載】特集1
ゲノム編集技術を産業応用! バイオエコノミー社会のカギとなる“バイオ DX”とは?
2025年11月19日 12時00分更新
2020年にノーベル化学賞を受賞したゲノム編集は、生物の遺伝情報を書き換える画期的な技術として産業応用に向けた動きが活発化している。広島大学ゲノム編集イノベーションセンターのセンター長を務める山本卓教授と、ゲノム解析を専門にする同大大学院統合生命科学研究科の坊農秀雅教授が主導する「Bio-Digital Transformation(バイオDX)産学共創拠点」では、生物のデジタル化とプログラミングの研究開発を推進。得られた成果を社会実装し、バイオエコノミー社会の実現に貢献することを目指している。
バイオエコノミー社会の実現
50以上の大学や企業が参画
「誰ひとり取り残さず」持続的な発展を可能とするバイオエコノミー社会の実現。このメッセージを掲げて研究開発の活動を進めているのが、JSTの共創の場形成支援プログラムに採択されている「Bio-Digital Transformation(バイオDX)産学共創拠点」(以降、バイオDX拠点)だ。広島大学が代表を務め、30以上の大学・研究機関、20社以上の企業などが参画するこの拠点では、生物が持つ機能を活用して食や健康、エネルギー問題などを解決し、SDGs(持続可能な開発目標)達成に貢献することを目指している。
バイオDX拠点の特徴は、生物の「デジタル化」と「プログラミング」の統合にある。生物のデジタル化とは、生物の遺伝情報を解読・解析し、コンピューターでシミュレーションできるようにすることを指す。生物のプログラミングとは、デジタル化によって得られた知見を基に、ゲノム編集技術を用いて、生物の遺伝情報であるDNAの塩基配列を書き換えて、有用な生物を作り出すことを意味する。
デジタル化は、生物データをコンピューターで解析する「バイオインフォマティクス」を長年専門にしてきた広島大学の坊農秀雅教授が研究機関を牽引(けんいん)している。また、生物のプログラミングを担当するのは、ゲノム編集で研究実績を持ち、プロジェクトリーダーでもある同大の山本卓教授だ。坊農さんと山本さんをはじめとする、関連する各分野のトップランナーが集結しているのがバイオDX拠点の強みである。
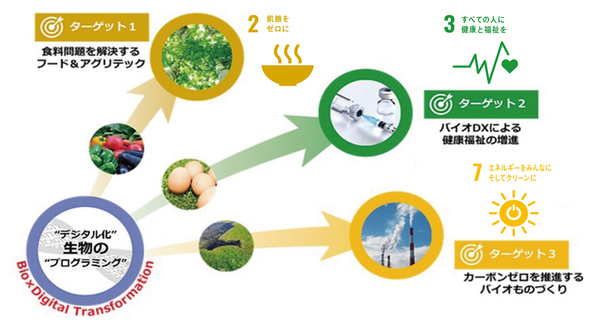
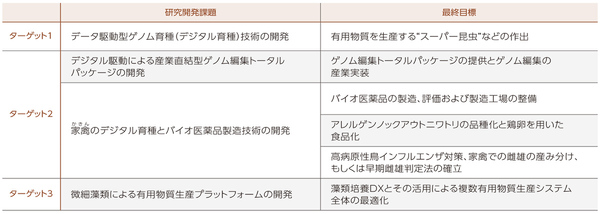
広島大学では、この拠点を2021年に終了したJSTの産学共創プラットフォーム共同研究推進プログラム(OPERA)の「『ゲノム編集』産学共創コンソーシアム」を発展させたものとして位置付けている。「OPERAはオールジャパン体制で研究を進め、ゲノム編集に関する多くの成果が得られました。その研究成果を基にした社会実装をさらに加速させようというコンセプトです」と山本さんは語る。この拠点では「バイオDXで持続可能な発展を導くバイオエコノミー」の実現を目指して3つのターゲットを掲げ(図1)、4つの研究開発課題と6つの最終目標を設定している(図2)。
母校での再会がきっかけ
プラチナTALENを開発
バイオDX拠点の中で、最も実用化に近くメディアからも注目されているのが、鶏卵アレルギーの原因物質が含まれない「アレルギー低減卵」の開発だ。広島大学大学院統合生命科学研究科の堀内浩幸教授が長年取り組んでいたテーマで、ゲノム編集技術を活用することでいよいよ実用化が近づいてきたという。
鶏卵アレルギーを引き起こす原因となる物質はいくつかある。その中でも卵白中のたんぱく質である「オボムコイド(OVM)」という成分は熱に強く、加熱処理してもアレルギーを引き起こしてしまう。堀内さんは、OVMを作る遺伝子を排除したニワトリが産んだ卵であれば、鶏卵アレルギーを引き起こさないのではないかと考えた。当初は遺伝子組み換え技術を使っていたが、開発は難航。遺伝子組み換えの場合、外来遺伝子が狙った場所以外にも入り込み、細胞に異常が生じてしまったのだ。当時の手法では9割ほどが異常な細胞になってしまい、解決策を模索していた時に、学生時代に広島大学遺伝子実験施設で机を並べて研究していた山本さんと母校で再会した。
2人は、互いに職場が変わってからも研究で接点があり、この再会を機にゲノム編集技術を取り入れることにしたという。現在のゲノム編集の主流は、2020年にノーベル賞を受賞した「CRISPR-Cas(クリスパーキャス)9」。しかし、この手法では書き換えられるDNA配列に制限があり、OVM遺伝子を完全には排除できない可能性がある。
そこで堀内さんらは「TALEN(ターレン)」と呼ばれるゲノム編集技術を改良し、山本さんらが独自に開発した「プラチナTALEN」という技術を使用している。「プラチナTALENはほぼ自由に設計でき、遺伝子を完全に取り除くことができます。広島大学発のスタートアップであるプラチナバイオ(広島県東広島市)が特許を管理しており、権利関係が明瞭なので産業応用のハードルも低くなります」と、その優位性をアピールする。
OVMノックアウト卵を作成
臨床試験成功後は海外展開も
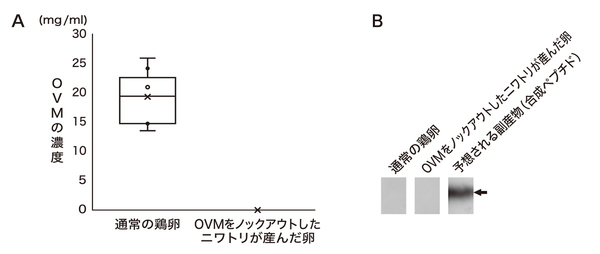
研究では、まず精子や卵子のもとになる細胞である始原生殖細胞をプラチナTALENでゲノム編集し、OVMを作る遺伝子を破壊(ノックアウト)。その後、遺伝子を破壊した精子と卵子から受精卵を作り、ふ化させた(図3)。堀内さんらは、こうして生まれたひなが成長して産んだ鶏卵に、たんぱく質レベルの解析によってOVMが含まれていないことを確認(図4-A)。さらに、抗体と抗原の特異的な相互作用を利用してたんぱく質を検出するイムノブロット法により、ゲノム編集の副産物として予想される変異OVMが検出されないことも確かめた(図4-B)。
ゲノム編集における一般的なリスクとして、標的とする遺伝子とは別の部位に変異を導入してしまうオフターゲット作用がある。そこで堀内さんらは、今回のゲノム編集で生まれたニワトリに対して、次世代塩基配列解析技術で全ゲノムDNA配列情報を決定する全ゲノム解析を実施。プラチナTALENによって他の遺伝子が挿入されたり、他の遺伝子領域へ変異が導入されたりするオフターゲット作用が見られないことを示した。
こうして作ったOVMを含まないアレルギー低減卵を加熱し、粉末にした上で鶏卵アレルギーの人に摂取してもらう臨床試験が相模原病院臨床研究センターで続けられており、現在までに30人の試験が終了し、今年度末までに合計で約50人の試験が終了する予定である。この臨床試験で安全性が確認されれば2年後には市場へ出し、東南アジアやインドへの展開も検討しているという。日本発のこの技術が実現すれば、世界中の鶏卵アレルギーの人にとって希望の光となるだろう。
社会実装に向けて山本さんは、世の中の人が喉から手が出るほど欲しいものを作ることが重要だと話す。「アレルギー低減卵は、卵を食べたくても食べられない方や家族の皆さんにとって、どうしても欲しいものの1つだと思います。一方で、ゲノム編集がどのようなものかわからないと不安を感じる人もいるでしょう。私たちが技術について丁寧に説明し、対話を通じて皆さんに理解してもらうことが大切だと考えています」。
「代謝パスウェイ」の解明進む
デジタル育種で社会実装へ
ゲノム編集を活用して有用な物質を作ったり、病気の原因を明らかにしたりするためには、ゲノム編集を施す生物のゲノム情報が明らかになっている必要がある。ところが、ほとんどの生物のゲノム情報は解読されていない。バイオDX拠点が掲げるターゲット1の研究開発課題で最終目標として挙げられている昆虫についても同様だ。
この拠点で、ゲノム解読・解析の研究を主導する坊農さんは以前、カイコを対象とした研究に15年間ほど取り組み、パーキンソン病に似た特徴を持つ変異体を解析。病態に関わる物質が体内で合成・分解される仕組みを解明した実績を持つ。坊農さんは「カイコはたんぱく質を多く作る性質があります。病原体のたんぱく質を大量に作らせることができれば、ワクチンとして利用できる可能性もあります」とゲノム解読・解析の有用性を話す。
有用な物質を生物の中で大量に作らせるためには、遺伝子配列を解析するだけでは十分ではない。実際にどの遺伝子が機能しているか、どのような物質が含まれているかを網羅的に解析して、その物質がどのような反応を経て作り出されるのかという「代謝パスウェイ」を明らかにする必要がある。
そこで坊農さんは、代謝パスウェイをコンピューター上で再現し、ある遺伝子を書き換えた時に代謝パスウェイ全体がどう変化するかをシミュレーションしている。「現段階では、有用物質を作りたくても、その代謝パスウェイがわかっていないことがほとんどです。シミュレーションで複数のパスウェイを候補にし、実験で成功したものを社会実装していくアプローチが重要になっています」と語る。
実験で得られるゲノム配列や遺伝子発現データ、すでに公開されているデータを用いて生物データをデジタル化してシミュレーションを実行し、ゲノム編集のターゲット遺伝子を選定する手法は「デジタル育種」と呼ばれている。坊農さんらは、企業との共同研究も実施している。殺虫剤メーカーと実施した、薬剤に抵抗性のあるトコジラミのゲノム解読の結果は今後、効果的な殺虫剤の開発につながることが期待される。
第1世代ゲノム編集を国産化
地域産業活性化にも取り組む
産業応用できるゲノム編集ツールの開発にも取り組む山本さんは、国産化と自動化の重要性を強調する。国産ツールは国内企業が扱いやすく、高速に自動作成した中からより有効なものを選抜できれば、さらなる低コスト化が期待できる。山本さんが現在着目しているのは、1996年に登場した第1世代のゲノム編集技術である「ジンクフィンガーヌクレアーゼ(ZFN)」というゲノム編集技術だ(図5)。ZFNはツール作成に時間とコストがかかり、あまり使われてこなかった。その後、2010年にTALENが発表され、12年に登場したCRISPR-Cas9は世界中の研究室で使われている。

図5 ZFN-ND1の模式図。DNAに結合するジンクフィンガーたんぱく質(DNA結合ドメイン)とDNAを切断する制限酵素(ヌクレアーゼドメイン)から成る人工制限酵素で、DNA結合ドメインを改変することで任意の配列を標的にすることができる。
この2つは特許が取得されているため高額なライセンス料を支払う必要があり、開発した技術を商用化する際の障壁となる可能性がある。だが、ZFNはすでに特許が切れており、ツール開発における時間とコストの課題さえ解決できれば有用な選択肢となり得る。山本さんらは、ZFNツールの作成を自動化するデジタルフロー型ツールの開発にも取り組んでおり「技術補佐員がセットして3日後には培養細胞で使えることを目標にしています」と展望を語る。
バイオDX拠点では他にも、微細藻類と呼ばれる微小な単細胞の藻類を利用してバイオ燃料や機能性成分であるエイコサペンタエン酸(EPA)を大量に生産する研究も進めている。さらに、バクテリアをゲノム編集する技術や、長期目標として花粉を作らないスギの開発も目指している。
この拠点には、地域産業との共創の側面もある。山本さんらは地元広島県の食品メーカーや酒造メーカーと共に地域産業に直結する生物のゲノムを解析するなど、今後、地元企業との協力をさらに加速させたいと意気込む。また、広島大学では大学院教育と産学連携における現場課題を結びつけることを重視し、学生の教育を進めてきた。坊農さんは、この取り組みを受けて修士号や博士号を取得した卒業生たちが産業界や研究の世界で活躍し始めていると語り「今後、若い世代の研究者がどんな成果を出すのか楽しみです」と期待に胸を膨らませている。

この連載の記事
-
第74回
TECH
白亜紀から続くロマンに惹かれて挑む、浮遊性有孔虫の研究 -
第73回
TECH
出芽酵母を用いて環状DNA発生の仕組みを明らかに -
第72回
TECH
病原細菌が植物の葉の気孔を開いて侵入する仕組みを発見 -
第71回
TECH
原子分解能電子顕微鏡法で、結晶粒境界における添加元素の拡散状況を観察 -
第70回
TECH
有機フッ素化合物を分解する新たな技術を開発 -
第69回
TECH
小中高生の可能性を広げる「次世代科学技術チャレンジプログラム」 -
第68回
TECH
和食に欠かせない魚の安定供給を目指す、持続可能な魚の養殖システム -
第67回
TECH
「見つける・調べる・操る」をキーワードにRNAの化学修飾を探求 -
第66回
TECH
あらゆる元素を扱う無機合成化学で新材料を創出し、社会問題の解決へ -
第65回
TECH
手術後の胆汁の漏れを防ぐ新たなハイドロゲルを開発 -
第64回
TECH
脳内の隙間細胞による、記憶を選んで残すメカニズム解明へ - この連載の一覧へ