【JSTnews8月号掲載】特集1
「ジャンク」とされたRNAの可能性を信じ続け、細胞の設計者としてのRNAを同定
2025年08月08日 12時00分更新
感染症にかかった時、私たちの体内では免疫細胞が活躍して健康な状態に戻そうとする。実は、細胞内レベルでも緊急時に機能を維持する「新たな」機構があることを、大阪大学大学院生命機能研究科の廣瀬哲郎教授らの研究チームが相次いで発見した。その機構のカギは、かつて「ジャンク」だと考えられていた「長鎖ノンコーディングRNA(lncRNA)」。廣瀬さんらは一連の発見を基に、病気のメカニズム解明や創薬への貢献を目指している。
セントラルドグマの例外
あえて研究テーマに選ぶ
生物の遺伝情報が細胞核内のDNAからメッセンジャーRNA(mRNA)に転写され、核外に出たmRNAがその塩基配列に対応する転移RNA(tRNA)と結合し、tRNAが運ぶアミノ酸がつながってたんぱく質を合成する。この一連の流れはセントラルドグマと呼ばれ、分子生物学の基本原理となっている。RNAには、mRNAとtRNA以外にも、たんぱく質合成の場であるリボソームを構成するリボソームRNA(rRNA)をはじめとするさまざまなRNAが見つかっている。
一方、たんぱく質の合成に関わらないノンコーディングRNAは、セントラルドグマの例外。中でも、1990年代以降に発見された、200塩基以上の長さを持つ長鎖ノンコーディングRNA(lncRNA)は当初、機能を持たない「ジャンク」と見なされていた。しかし、近年になって遺伝子発現の制御やがんの発生などへの関与が明らかになり、注目されている。大阪大学の廣瀬教授は、ジャンク扱いされていた時期からlncRNAに着目し、病気のメカニズム解明や創薬への貢献を胸に研究を続けている。
廣瀬さんが米国留学から帰国し、産業技術総合研究所で自身の研究室を構えた2005年は、ヒトゲノム計画がほぼ完了し、得られたゲノム情報の活用に目が向けられ始めたポストゲノム時代の幕開けのタイミング。また、解読されたヒトゲノムは、その98パーセントがたんぱく質の情報を含まない広大なジャンクで示されていることがわかった時期でもあった。
そうした状況下で、哺乳類のゲノムの広大なジャンク領域の約75パーセントが転写され、たんぱく質情報を持たない機能不明のRNAを大量に合成していると国際研究コンソーシアム「FANTOMプロジェクト」が驚くべき報告をした。それまで長年RNAの研究を続けてきた廣瀬さんは、その内容にショックを受けたものの、あえてこの機能不明なRNAであるlncRNAを研究テーマに選んだという。
学生時代に植物細胞の葉緑体の遺伝子発現を研究していた廣瀬さんは、RNA制御の精密さを知っていた。「ヒトでは、RNAがさらに複雑な意味や機能を持っていて、きっと何か面白いことをしているに違いないとRNAを信じていました。加えて、当時lncRNAの中から機能を見いだす研究をしている研究者は、世界中でほとんどいなかったので、ここで新しいものを見つけてやりたいという気持ちもありましたね」。
非膜オルガネラの仕組みを解析
「足場」が設計図の役割も持つ
高校生物の教科書では、核やミトコンドリアなどの細胞小器官である「オルガネラ」は膜に覆われていると記述されている。しかし、膜で覆われていないにもかかわらず特定の分子群が集まって、他と混じり合わない「非膜オルガネラ」の存在が近年明らかになった。細胞内というゾル状の環境で、それぞれの非膜オルガネラがどのようにして独立して存在しているのか。その「細胞内相分離」のカギとなっていたのが、廣瀬さんらが研究していたlncRNAだった。
手応えのある結果がなかなか得られず、苦しい試行錯誤を3年続けたある日、廣瀬さんらは、追いかけていたlncRNAの一種である「NEAT1(ニートワン)」が、細胞核の中に存在して主にRNAと特定のたんぱく質から成り立つ構造体「パラスペックル」だけに局在していることに気付いた。そこでNEAT1RNAを取り除いたところ、パラスペックル自体が消えてしまった。パラスペックルは、NEAT1を「足場」として形成されていたのだ。
文字通り、まさにジャンクの山からダイヤモンドの原石を発見した廣瀬さん。「それまでの研究者人生で、最もエキサイティングな瞬間でした」と振り返り、この意外性が忘れられずに、以来15年以上にわたってlncRNAの研究を続けていると語る。
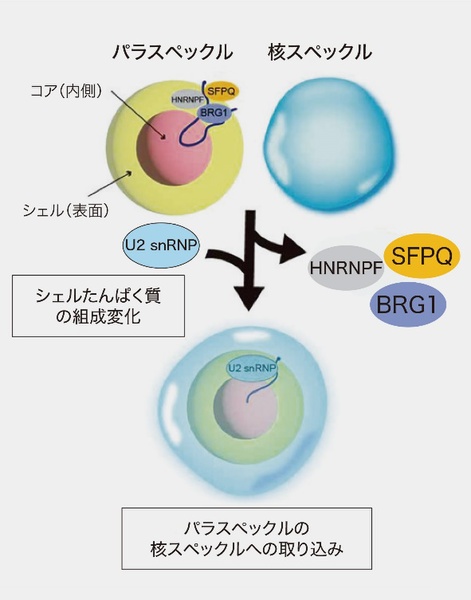
図1 非膜オルガネラであるパラスペックルが、細胞内で他の非膜オルガネラと混じり合わない仕組みを調べるための実験。核内低分子RNAである「U2 snRNP」をパラスペックルのシェルに配置すると、パラスペックルの独立性を保つ役割を持つたんぱく質(SFPQ、BRG1、HNRNPF)とシェルとの結合が抑制され、パラスペックルは別の非膜オルガネラである核スペックルに取り込まれた。
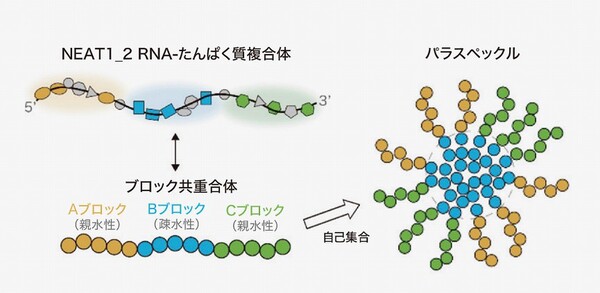
非膜オルガネラであるパラスペックルは、表面の「シェル」と内側の「コア」という2層からなる液滴(図1)。高分子ブロックが2種類以上つながったブロック共重合体が自己集合し、水になじみやすい親水性のブロックであるシェルが、水になじみにくい疎水性のブロックであるコアを包み込む構造をとっている(図2)。
パラスペックルが非膜オルガネラと混じり合わずに独立して存在できるのは、パラスペックルのシェルを形成するたんぱく質の組成に理由があった。シェルのたんぱく質組成を人為的に崩すと、パラスペックルは独立性を失い、近くに存在する別の非膜オルガネラに取り込まれてしまうことも廣瀬さんらの研究チームが明らかにした。
さらに、NEAT1がパラスペックル形成に必要なたんぱく質を自ら集めて配置を制御し、適切に組み立てる設計図としての役割を持つことを突き止め、このような機能を持つRNAを「アーキテクチュラルRNA(arcRNA)」と命名した。lncRNAはジャンクだとされてきた歴史を覆し、NEAT1はパラスペックルを作る足場になるだけでなく、その性状や役割をも決定づけるほどに多機能であることを示したのだ。
熱ストレスからの回復を促進
「スポンジ」「るつぼ」の働きで
lncRNAの研究を進める廣瀬さんらの研究チームは他にも多数の成果を上げている。霊長類の細胞を42度の高温にさらすと、高温による熱ストレスからの回復期に遺伝子発現を調節する役割を持つ非膜オルガネラである「核内ストレス体」が形成される。この核内ストレス体が、arcRNAの一種である「HSATⅢ(エイチサットスリー)」を足場にして作られる。
HSATⅢは、普段は転写されないように制御されているが、熱ストレスがかかると転写が始まり、元のDNA領域と同様にグアニン・グアニン・アデニン・アデニン・ウラシル(GGAAU)という反復配列を持つ。その単純な反復配列に部分的にメチル基が付加するRNA修飾を受けること、またHSATⅢに結合したたんぱく質がリン酸化を受けることで、核内ストレス体が温度の変化に応答した異なる2種類のスプライシングの制御機構を両立させていることも明らかにした。スプライシングとは、RNAが核内から出ていく前に、たんぱく質生成に関わる情報を持たない部分を取り除いて残りの部分を再結合するプロセスである。
1つ目の仕組みはこうだ。熱ストレスからの回復過程で、核内ストレス体は周囲のメチル化関連たんぱく質を閉じ込める「スポンジ」として働く。このスポンジは、特定のたんぱく質や核酸を構造体内に大量に取り込むことで、周囲の細胞内領域での濃度を低下させ、分子本来の機能を阻害する。さらに、周囲のmRNAのメチル化修飾を抑制し、メチル化修飾によって起こるスプライシングも抑制する。
加えて、核内ストレス体は、特定のたんぱく質や核酸を構造体内に集めて濃縮し、分子間の相互作用や酵素反応を促進・増強させる「るつぼ」としても機能し、熱ストレス応答状態から正常な状態への回復を促進する(図3)。廣瀬さんらの実験により、核内ストレス体を持たないマウスの細胞では熱ストレスからの回復に6時間を要するが、核内ストレス体を持つヒト細胞では1時間以内に回復することがわかった。

図3 核内ストレス体の蛍光顕微鏡イメージ(左)。HSATⅢ(緑)とメチル化関連因子(ピンク)が重なって存在しているため白く見えているのが核内ストレス体。右図は核内ストレス体の機能を説明するモデル。熱ストレスに応答してHSATⅢを足場にして形成された核内ストレス体は「スポンジ」と「るつぼ」としての働きを通して、細胞の正常な回復を促進する。
これらの反応は相分離を巧みに利用していると廣瀬さんは説明する。「必要な分子だけを選択的に集めて閉じ込め、不要な物質を排除して濃縮する。これこそが相分離の原理で、この現象を支えているのがarcRNAです」。核内ストレス体の発見から30年、RNAの機能解明は大きく前進した。
RNAのメチル化修飾は、生体内のさまざまな生理機能やがんをはじめとする疾患の発症メカニズムに関わっている。廣瀬さんらの研究で高温によるストレス応答とRNAメチル化修飾が機能的につながっていると明らかになったことで、霊長類が熱ストレス応答機能を獲得した経緯や疾患の発症メカニズムの解明につながることが期待される。
コラム:RNA修飾とは?
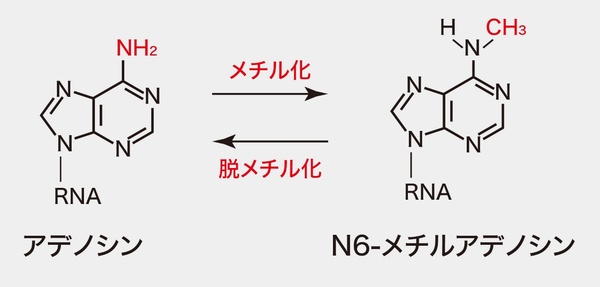
DNAから転写されたRNAは、一部の塩基や単糖の1つであるリボースにメチル基が付加されるメチル化(図)や、アセチル基が付加されるアセチル化など、さまざまな変更を受ける。これまでに100種類を超える変更が見つかっており、これらをRNA修飾と呼ぶ。RNA修飾は、たんぱく質が適切な種類や量で合成されるよう遺伝子の発現を調整する役割を果たし、生殖、寿命、約24時間周期の生体リズムなどの生命現象や、がんをはじめとする多くの疾患と関わりがあると報告されている。RNAの塩基配列自体は変えずに後天的な遺伝子発現を制御する研究分野である「エピトランスクリプトミクス」においても重要な研究テーマとなっている。
難溶性のRNAを効率的に抽出
ヒト細胞から1074種類を同定
廣瀬さんらの研究チームは、NEAT1の働きを調べる研究を通じて、一般的な方法では抽出されにくい性質を持つ「難溶性RNA」と呼ばれるRNAの全体像や特徴の解明にも貢献した。全てのRNAはたんぱく質と結合しているが、難溶性RNAの1つであるNEAT1は多数のたんぱく質とより強固に結合して存在している。そのため、フェノールとクロロホルムを用いてRNAを水層に移行させて抽出する「AGPC法」と呼ばれる一般的なRNA抽出法では効率的に抽出されにくい。そこで、加熱したり、細胞溶解液を注射針に通してたんぱく質を物理的に引き剥がしたりして抽出方法の改良を試み、NEAT1の抽出量を劇的に増加させることに成功した(図4)。
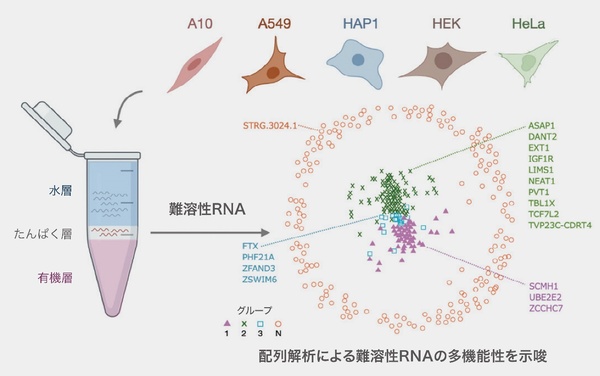
図4 一般的なRNA抽出法ではたんぱく質層に移行してしまう難溶性RNAを、加熱したり、物理的にたんぱく質から引き剥がしたりすることで抽出効率を上げることに成功。1074種類の新たな難溶性RNAを発見した。(早稲田大学・浜田道昭教授との共同研究)
難溶性RNAの効率的な抽出法の発見は、確かなスキルを持ちながらも、NEAT1の抽出量にぶれがあることに悩んだ研究員からの相談がヒントとなったと廣瀬さんは語る。「イレギュラーな結果を見逃さないことです。いつもと違うことにこそ、面白いことが隠れています。99パーセントが実験ミスであっても、残り1パーセントは大発見につながる可能性があります」。
廣瀬さんらはさらに、次世代シーケンス解析や共同研究で整備した独自のバイオインフォマティクス解析パイプラインを組み合わせて、NEAT1以外の難溶性RNAを探索した。その結果、5種類のヒト培養細胞から、新たに1074種類の難溶性RNAを同定することに成功。難溶性RNAという今まで見逃されていた世界の扉を開いた。
異分野との共同研究が不可欠
妥協しないでベストを目指す
30年以上にわたる研究者生活を通して、廣瀬さんは対象とする研究領域を大きく広げてきた。非膜オルガネラの構造や物性解析など多岐にわたるアプローチを統合するためには、異分野の研究者との共同研究が不可欠だ。共同研究が始まるきっかけは、研究会などで互いの研究に興味を持った人との出会いが多い。軽いフットワークでいろいろなシンポジウムに参加し、研究の楽しさを話す機会を持つことが大切となる。
「研究の面白さや互いの価値観を分かち合えるオープンマインドな姿勢を持つ人との出会いはとても貴重です」と廣瀬さんは説明し、自身も波長の合う相手を見つけたら信頼関係が長く続くよう大切にしている。JSTのCRESTで共同研究者として採択されている、国立がん研究センター研究所の足達俊吾部門長や大阪大学産業科学研究所の中谷和彦特任教授、堂野主税准教授とも日々コミュニケーションを取りながら研究を進めている。
かつてはほとんど見向きもされなかったlncRNAをテーマに選び、ここまで業績を積み上げられた理由を「みんなが面白いと言っていることはなるべく避け、決して妥協せずベストを目指してきました」と語った廣瀬さん。淡々としながらも、その姿には秘められたRNAの機能を解明しようとする情熱であふれていた。

この連載の記事
-
第74回
TECH
白亜紀から続くロマンに惹かれて挑む、浮遊性有孔虫の研究 -
第73回
TECH
出芽酵母を用いて環状DNA発生の仕組みを明らかに -
第72回
TECH
病原細菌が植物の葉の気孔を開いて侵入する仕組みを発見 -
第71回
TECH
原子分解能電子顕微鏡法で、結晶粒境界における添加元素の拡散状況を観察 -
第70回
TECH
有機フッ素化合物を分解する新たな技術を開発 -
第69回
TECH
小中高生の可能性を広げる「次世代科学技術チャレンジプログラム」 -
第68回
TECH
和食に欠かせない魚の安定供給を目指す、持続可能な魚の養殖システム -
第67回
TECH
「見つける・調べる・操る」をキーワードにRNAの化学修飾を探求 -
第66回
TECH
あらゆる元素を扱う無機合成化学で新材料を創出し、社会問題の解決へ -
第65回
TECH
手術後の胆汁の漏れを防ぐ新たなハイドロゲルを開発 -
第64回
TECH
脳内の隙間細胞による、記憶を選んで残すメカニズム解明へ - この連載の一覧へ