規制当局への副作用報告形式の新規格「E2B(R3)」に対応
キヤノンITSが「EDI-Master DEX for Medical」新版を発売
2016年09月27日 10時00分更新
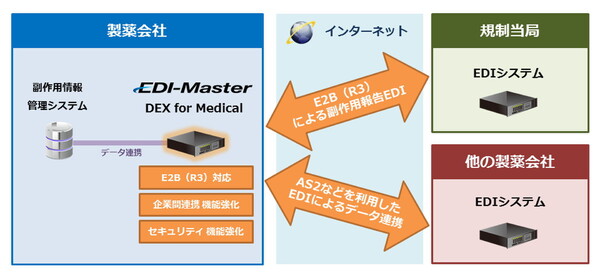
キヤノンITソリューションズ(キヤノンITS)は9月27日、製薬企業向けEDIシステム「EDI-Master DEX for Medical」の新版(バージョン5)を発売した。PMDA(医薬品医療機器総合機構)に対する副作用報告形式の新規格「E2B(R3)」に対応した。
EDI-Master DEX for Medicalは、製薬企業と規制当局(PMDA/厚生労働省)の間で行われる医薬品等の副作用報告を電子的に行うためのEDIシステム。80社を超える製薬企業で導入実績がある。
今回のバージョンアップでは、従来からのE2B(R2)に加えて、今年4月から運用が始まっているE2B(R3)にも対応した。製薬企業がこれを利用することで、R2/R3の並行運用期間(2019年3月まで)中に、確実に移行を完了できる。
さらに、グループ会社やパートナー企業など、他の製薬会社との間でのデータ連携機能を強化したほか、IPAガイドラインに基づくセキュリティレベル設定機能の追加、NSA(米国国家安全保障局)の「Suite B」暗号方式に対応している。
価格は700万円(税別)から。キヤノンITSでは、2020年までに製薬企業を中心とする累計100社のシステム構築/導入を獲得し、EDIソリューション関連事業において年間売上高25億円を目指すとしている。