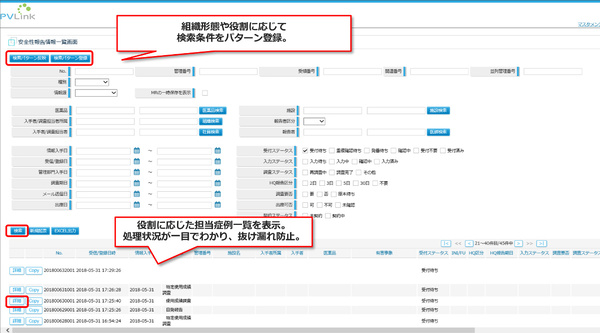
MRや安全管理部門がブラウザから入力/一覧可能、期日アラートで報告遅延や報告漏れを防ぐ
キヤノンITS、医薬品安全性報告の進捗管理支援システムを発売
2018年06月18日 10時00分更新
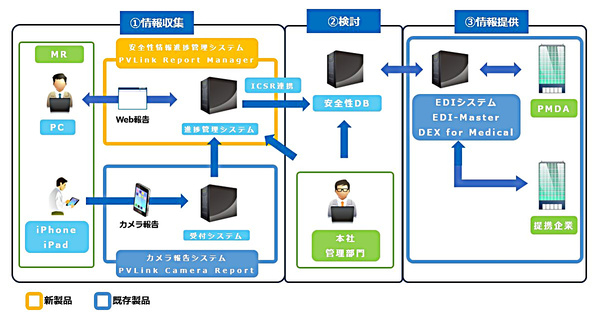
キヤノンITソリューションズ(キヤノンITS)は2018年6月18日、製薬会社における医薬品安全性報告(副作用報告など)の進捗管理業務を支援するシステム「PVLink Report Manager」を提供開始した。報告入力から調査、EDIへの連携まで一連の業務プロセスを標準機能としてパッケージ化し、同時に製薬会社ごとに異なる詳細な要件は設定変更で柔軟に対応することで、低コスト/短期間でのシステム構築を可能にする。
国内製薬会社では、医薬品の副作用と疑われる症例を確認した場合、医薬品医療機器総合機構(PMDA)に対し副作用情報を報告することが義務づけられている。こうした情報は製薬企業のMR(医薬情報担当者)が医療機関等を訪問して収集し、社内の安全管理部門が取りまとめてPMDAに報告するが、その期限は72時間以内(重篤度の高い副作用の場合は24時間以内)と定められており、一連の業務プロセスには迅速さと正確さが求められる。
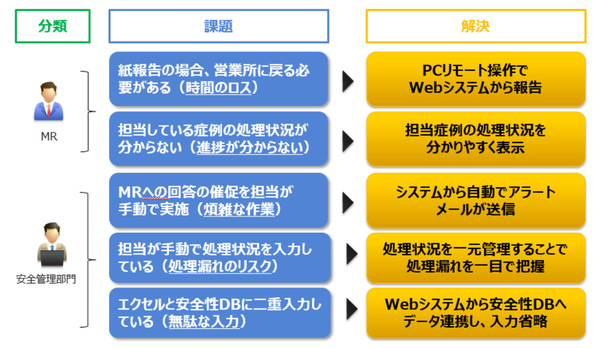
だが、安全管理部門とMRとは副作用情報の詳細を調査するために複数回のやり取りをすることが一般的であり、企業によっては数千人ものMRを抱えることからその進捗管理には大きな業務負荷がかかり、報告遅延や報告漏れのリスクが課題となっている。またMRからは、外出先から迅速かつ安全に報告したいという要望が上がっている。
キヤノンITSではこれまで、電子的個別症例安全性報告(ICSR)を行うEDIシステム「EDI-Master DEX for Medical」や、MRがモバイルデバイスのカメラを使って副作用報告を行える「PVLink Camera Report」を提供してきた。今回、新たなソリューションラインアップとして、副作用報告の進捗管理システムであるPVLink Report Managerを追加する。
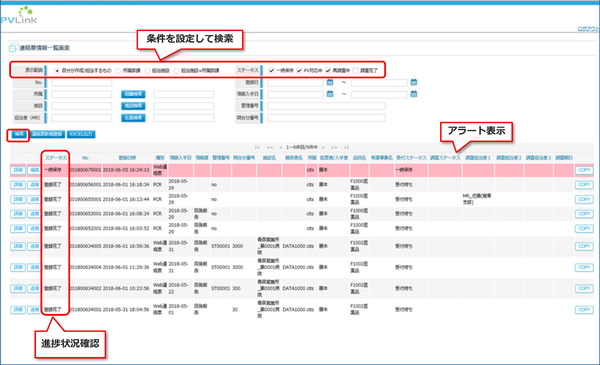
PVLink Report Managerでは、MRと安全管理部門それぞれの業務を効率化し、進捗管理支援による報告遅延や報告漏れを防ぐ機能が提供される。たとえばMR向けには、PCやスマートデバイスのブラウザを通じて副作用報告を入力できる機能や、期日アラート付きの一覧表示により進捗状況を管理する機能が提供される。また安全管理部門向けには、一元化されたデータベースと柔軟な検索機能、自動アラート連絡機能などが提供され、連絡漏れを防ぐ。安全管理部門からMRへの連絡メールのテンプレート機能もある。
同製品では、こうしたプロセスの進捗管理業務にまつわる基本機能(報告/収集/進捗管理/調査/ICSR連携)をパッケージ化する一方で、製薬会社ごとに異なる要件(画面構成/入力項目/デザインなど)については、追加開発(カスタマイズ)ではなく設定変更で対応できる仕組みとしている。これによりコンピューターシステムバリデーション(CSV)の必要もなくし、フルスクラッチ開発やカスタマイズによる導入よりも大幅にコストを下げられるとしている。税抜価格は1000万円から。